Badania kliniczne. Podstawowe informacje na start.
Co roku na świecie prowadzone są badania kliniczne, w których bierze udział setki tysięcy uczestników. Mają one znaczący wpływ na ochronę zdrowia ze względu na ich istotną rolę w rozwoju nowych leków, terapii. Poniższy wpis jest skondensowanym wprowadzeniem do badań klinicznych. Zachęcam do przeczytania.

Jaka jest definicja badania klinicznego?
Definicja badania klinicznego została zawarta w art. 2 ust. 2 pkt 2 rozporządzenia Parlamentu Europejskiego i Rady (UE) nr 536/2014 z dnia 16 kwietnia 2014 r. w sprawie badań klinicznych produktów leczniczych stosowanych u ludzi oraz uchylenia dyrektywy 2001/20/WE (Dz. Urz. UE L 158 z 27.05.2014, str. 1, z późn. zm.[10])), zwanego dalej „rozporządzeniem 536/2014” i ma ona zastosowanie do wszystkich badań klinicznych prowadzonych w Unii.
Badanie kliniczne oznacza badanie biomedyczne spełniające którykolwiek z następujących warunków:
- przydział uczestnika do danej strategii terapeutycznej ustalany jest z góry i odbywa się w sposób niestanowiący standardowej praktyki klinicznej zainteresowanego państwa członkowskiego;
- decyzja o przepisaniu badanego produktu leczniczego jest podejmowana łącznie z decyzją o włączeniu uczestnika do badania biomedycznego; lub
- oprócz standardowej praktyki klinicznej u uczestników wykonuje się dodatkowe procedury diagnostyczne lub procedury monitorowania;
W pełnym zrozumieniu tak ujętej definicji potrzebna nam jest jeszcze definicja badania biomedycznego, która również została zawarta w niniejszym rozporządzeniu.
Badanie biomedyczne oznacza każde badanie dotyczące ludzi, mające na celu:
- odkrycie lub potwierdzenie klinicznych, farmakologicznych lub innych farmakodynamicznych skutków jednego lub większej liczby produktów leczniczych;
- stwierdzenie wszelkich działań niepożądanych jednego lub większej liczby produktów leczniczych; lub
- zbadanie wchłaniania, dystrybucji, metabolizmu i wydalania jednego lub większej liczby produktów leczniczych; mające na celu upewnienie się co do bezpieczeństwa lub skuteczności tych produktów leczniczych
Kto jest zaangażowany w proces badania klinicznego?
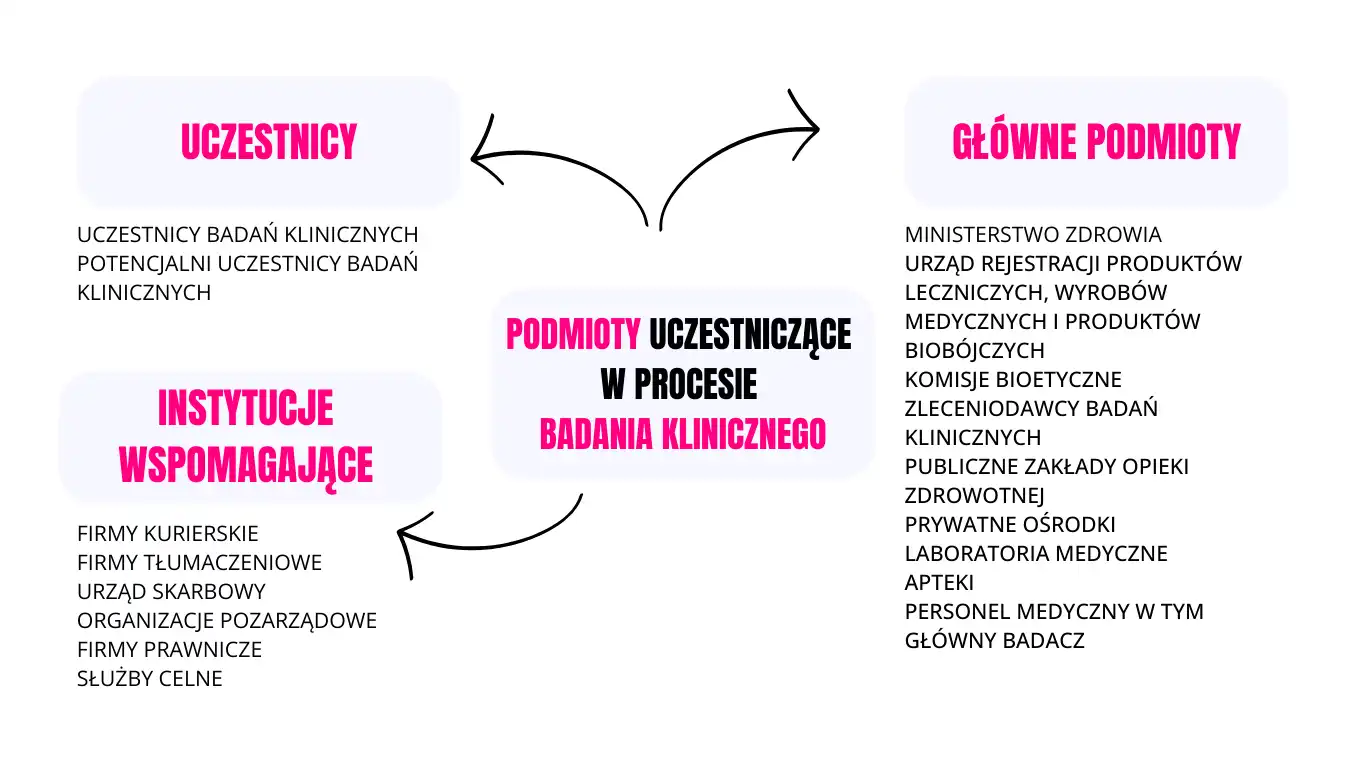
Badanie kliniczne jest skomplikowanym procesem. Potrzebne jest wykonanie setek, a czasem i tysięcy procedur przy zaangażowaniu wielu podmiotów i osób, abyśmy przy określonym schorzeniu mogli zastosować dany lek. Poniższa grafika przedstawia mnogość podmiotów uczestniczących w procesie badania klinicznego.
Przeczytałeś już Drogi Czytelniku/ Czytelniczko definicję badania klinicznego i podmioty uczestniczące w procesie, warto pochylić się zatem po co właściwie badania kliniczne są prowadzone.
Najlepszym rezultatem badania klinicznego z punktu widzenia firmy farmaceutycznej/ sponsora jest:
- zgoda na wprowadzenie nowego leku na rynek,
- rozszerzenie wskazania do stosowania istniejącego już leku przy innej jednostce chorobowej niż ta, która została przebadana już wcześniej,
- wprowadzenie nowej postaci farmaceutycznej leku.
Największą korzyścią dla nas jako pacjentów jest możliwość dostosowania takiego leczenia, które z jednej strony będzie skuteczne tzn. wyleczy nas z naszego schorzenia lub przynajmniej załagodzi jego skutki, a z drugiej będzie bezpieczne.
Celem badania klinicznego jest uzyskanie danych, których analiza potwierdza lub zaprzecza skuteczność i bezpieczeństwo badanego produktu leczniczego. Dane te są zbierane w różnych fazach badania klinicznego – w całym procesie badania klinicznego rozróżniamy 4 fazy.
- faza ma na celu ustalenie bezpiecznej dawki dla uczestnika badania. W tej fazie biorą udział zazwyczaj młodzi i zdrowi mężczyźni. Długość tej fazy zazwyczaj trwa od 2 do 12 miesięcy. Zbieramy w niej informacje dotyczące głównie bezpieczeństwa;
- faza ma na celu ustalenie lub doprecyzowanie skutecznego dawkowania. Sprawdzamy wstępną skuteczność. W fazie tej biorą udział uczestnicy, cechujący się łagodnym lub średnim nasileniu choroby. Faza trwa 1- 2 lata;
- faza ma na celu potwierdzenie skuteczności wcześniejszego założenia. W dalszym ciągu zbierane są dane dotyczące bezpieczeństwa i skuteczności. Porównywany jest również stosunek kosztu do korzyści. W fazie uczestniczy większa grupa chorych, która ma reprezentować docelową populację. Faza trwa od 1 do 5 lat;
- faza ma na celu monitorowanie bezpieczeństwa na większej grupie osób oraz badać interakcję z innymi lekami. Faza ta odbywa się, gdy lek został już zarejestrowany. Trwa około 2 lata.
Na koniec dzisiejszego wpisu wypiszę aktualnie obowiązujące regulacje krajowe, które dotyczą badań klinicznych:
Ustawa z dnia 9 marca 2023 r. o badaniach klinicznych produktów leczniczych stosowanych u ludzi
Ustawa z dnia 7 kwietnia 2022 r. o wyrobach medycznych
Ustawa z dnia 18 marca 2011 r. o Urzędzie Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (z późn. zm. akt ujednolicony)
Ustawa z dnia 6 września 2001 r. Prawo Farmaceutyczne (z późn. zm. akt ujednolicony)
Rozporządzenie Ministra Finansów z dnia 2 grudnia 2022 r. w sprawie obowiązkowego ubezpieczenia sponsora i badacza w związku z prowadzeniem badania klinicznego wyrobu lub badania działania wyrobu medycznego do diagnostyki in vitro
Rozporządzenie MZ z dnia 20 września 2022 r. zmieniające rozporządzenie w sprawie rodzajów, zakresu i wzorów dokumentacji medycznej oraz sposobu jej przetwarzania (zmiana Dz.U. 2020 poz. 666)
Rozporządzenie MZ z dnia 16 lutego 2016 r. w sprawie szczegółowych wymagań dotyczących planowania, prowadzenia, monitorowania i dokumentowania badania klinicznego wyrobu medycznego
Rozporządzenie MZ z dnia 9 listopada 2015 r. w sprawie wymagań Dobrej Praktyki Wytwarzania (z późn. zm. akt ujednolicony)
Dziękuję za poświęcony czas